Что такое гуморальный иммунитет?
Автор - молекулярный биолог кбн Алена Макарова
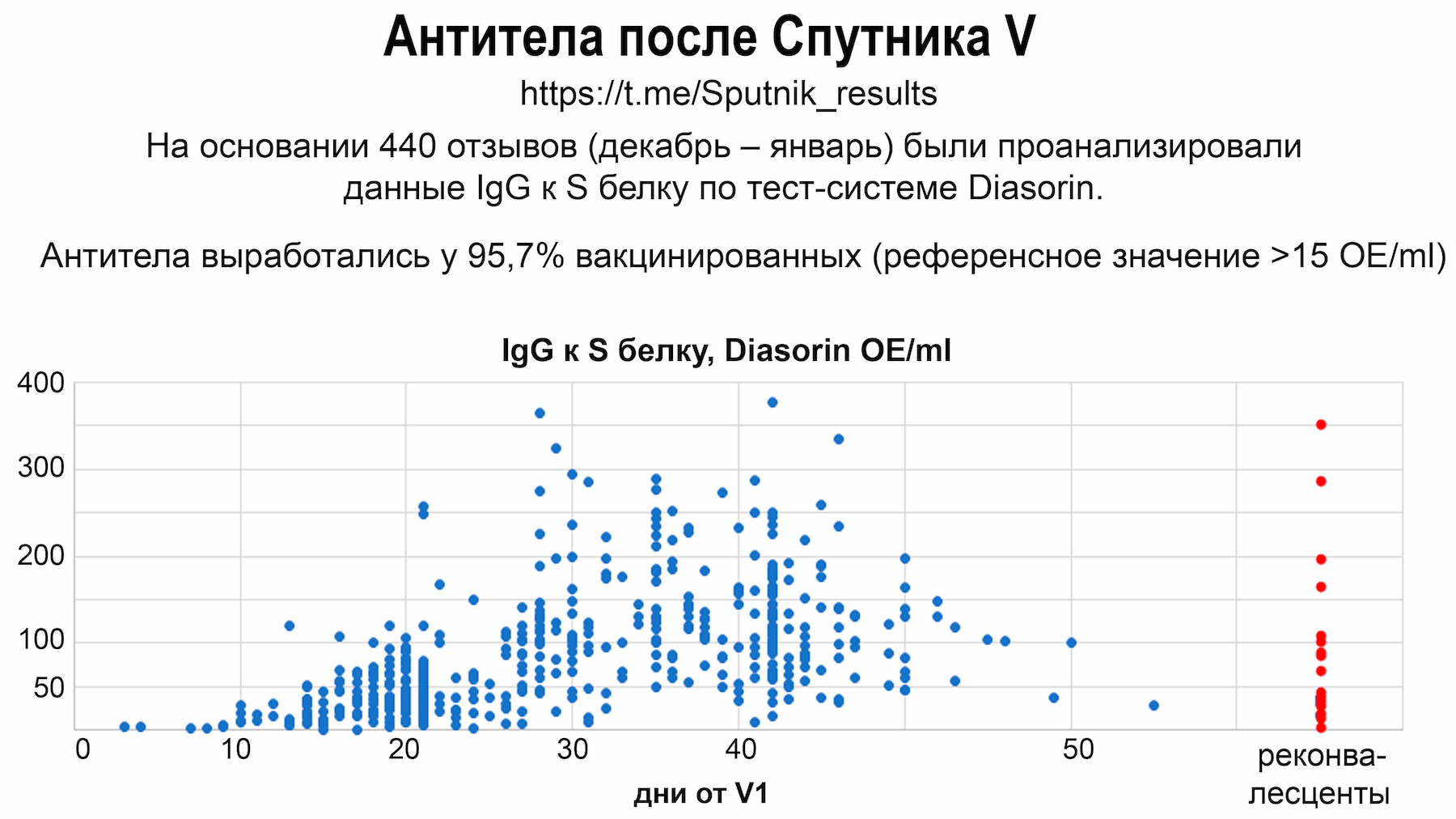
После вакцинации, как и после болезни covid-2019, сначала образуются ранние антитела IgM и IgA (сывороточные) (с 7-14 суток), которые держатся несколько недель, а затем – IgG (с 14-30 суток), которые держатся несколько месяцев. На 30-60 сутки после вакцинации наблюдаются максимальные значения IgG.
Динамика образования антител после болезни, аденовирусных и мРНК вакцин описана в научных статьях:
- Longitudinal observation and decline of neutralizing antibody responses in the three months following SARS-CoV-2 infection in humans (на англ. языке)
- Persistence and decay of human antibody responses to the receptor binding domain of SARS-CoV-2 spike protein in COVID-19 patients (на англ. языке)
- Antibody titers against SARS-CoV-2 decline, but do not disappear for several months (на англ. языке)
- COVID-19 and the Path to Immunity (на англ. языке)
- Persistence of SARS-CoV-2-specific B and T cell responses in convalescent COVID-19 patients 6–8 months after the infection (на англ. языке)
Антитела распознают эпитопы – уникальные участки чужеродных белков (антигенов). Часть антитела, распознающая эпитоп, называется паратопом. К некоторым эпитопам антитела образуются чаще, чем к другим. Антитела синтезируются В-лимфоцитами. «Наивные» В-лимфоциты (в лимфоузлах и селезенке) при первой встрече с антигеном активируются, начинают делиться, проходят селекцию на прочное связывание антигена и «превращаться» в плазматические клетки, которые секретируют антитела. Часть клонов В-лимфоцитов становятся В-клетками памяти – долгоживущими В-лимфоцитами, которые обеспечат быструю выработку большого количества IgG антител (минуя IgM) при повторной встрече организма с антигеном. Большинство плазматических клеток погибает после исчезновения антигена в организме, но около 10-20% плазматических клеток живет дольше и также вносит вклад в долговременный иммунитет.
Не все антитела одинаково полезны. Есть особенно ценные антитела, которые связывают вирус в ключевых участках, блокируя его способность взаимодействовать с клеткой и нейтрализуя вирус. Такие антитела называются нейтрализующими. Большинство нейтрализующих антител образуется к RBD домену спайк-белка (S белка) коронавируса, которым он «прикрепляется» к рецептору АСЕ2 на поверхности клеток. Вирус, связанный IgG к RBD, не может проникнуть в клетку и ее заразить. Эффективность вакцин напрямую зависит от способности антител нейтрализовать вирус. По уровню нейтрализации вакцины можно разместить в убывающем порядке: 1 - мРНК (Pfizer, Moderna), 2 - аденовирусные (Спутник, AstraZeneca, Johnsson and Johnsson, CanSino), 3 – инактивированные.
- Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection (на англ. языке)
- SARS-CoV-2 spike protein: a key target for eliciting persistent neutralizing antibodies (на англ. языке)
- Seroconversion and Abundance of IgG Antibodies against S1-RBD of SARS-CoV-2 and Neutralizing Activity in the Chilean Population (на англ. языке)
- Rapid Generation of Neutralizing Antibody Responses in COVID-19 Patients (на англ. языке)
- Potent neutralizing antibodies against multiple epitopes on SARS-CoV-2 spike (на англ. языке)
- Neutralizing Antibodies Correlate with Protection from SARS-CoV-2 in Humans during a Fishery Vessel Outbreak with a High Attack Rate (на англ. языке)
- Relationship between Anti-Spike Protein Antibody Titers and SARS-CoV-2 In Vitro Virus Neutralization in Convalescent Plasma (на англ. языке)
Есть антитела, которые просто связывают вирусные белки на поверхности, но это не приводит к инактивации вируса. Также есть антитела и к внутренним белкам вируса (например, N нуклеокапсидному белку), эти антитела не видят «спрятанные» внутри вириона белки, не смогут связаться с вирионом и его нейтрализовать. Однако, ненейтрализующие антитела тоже могут быть полезны, если соответствующие им белки экспонируются на мембране (не все белки могут экспонироваться). Такие антитела «помечают» уже зараженную клетку, которая презентует на поверхности антигены вируса, привлекая другие иммунные клетки и белки, которые убивают ее:
- натуральные киллеры (антителозависимая цитотоксичность),
- фагоциты (антителозависимый фагоцитоз),
- белок С1q системы комплемента и мембраноатакующий комплекс (комплемент-зависимая цитотоксичность).
Все существующие мРНК и аденовирусные вакцины стимулируют выработку антител только к спайк-белку, среди этих антител - большой процент нейтрализующих. Инактивированные цельновирионные вакцины стимулируют выработку антител ко всем белкам вируса. При инактивации вируса возможно повреждение спайк-белка и снижение количества/качества нейтрализующих антител, однако антитела к другим белкам могут быть полезны для борьбы с новыми штаммами за счет антителозависимой цитотоксичности. Роль антителозависимой цитотоксичности в защите от SARS-CoV-2 не изучена. С другой стороны, ненейтрализующие антитела в инактивированных вакцинах могут потенциально играть роль в развитии антитело-зависимого усиления инфекции (АЗУИ), хотя данный механизм для SARS-CoV-2, к счастью, не описан.
